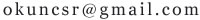pH=5的硫酸溶液,c(H+)=10^-5mol/l,c(SO42-)=5*10^-6mol/l
从2ml稀释到1L,体积扩大了500倍,PH是约为7,则c(H+)约为10^-7mol/l。
c(SO42-)的浓度缩小500倍,则c(SO42-)=10^-8mol/l;
所以,c(SO42-)与c(H+)之比约为1:10
(注:pH=5的硫酸溶液,若稀释十倍,则pH=6,稀释一百倍,PH是约为7,不能大于7。之后稀释更大也是如此,只能接近7,不能大于7。)
问下,问题是不是写错了,是1:10吧??追问
从2ml稀释到1L,体积扩大了500倍,PH是约为7,则c(H+)约为10^-7mol/l。
c(SO42-)的浓度缩小500倍,则c(SO42-)=10^-8mol/l;
所以,c(SO42-)与c(H+)之比约为1:10
(注:pH=5的硫酸溶液,若稀释十倍,则pH=6,稀释一百倍,PH是约为7,不能大于7。之后稀释更大也是如此,只能接近7,不能大于7。)
问下,问题是不是写错了,是1:10吧??追问
pH=5的硫酸溶液,c(H+)=10^-5mol/l,c(SO42-)=5*10^-6mol/l,c(SO42-)=5*10^-6mol/l怎么得的?c(SO42-)的浓度缩小500倍,则c(SO42-)=10^-8mol/l; 10-8怎么得的。。
摁摁。。是1:10
pH怎么定义知道吧,pH是氢离子浓度的负对数,pH=5,所以,c(H+)=10^-5mol/l。又从硫酸(H2SO4)的化学式知道,c(H+):c(SO42-)=,2:1,所以,c(SO42-)=5*10^-6mol/l。
温馨提示:内容为网友见解,仅供参考
第1个回答 2012-04-09
从2ml稀释到1L,体积扩大了500倍,PH是7,氢离子浓度就是水电离出氢离子浓度,为10^-7mol/l
pH=5的硫酸溶液氢离子浓度为10^-5mol/l,是硫酸根离子浓度的两倍
体积扩大了500倍,硫酸根的浓度缩小500倍,所以此时硫酸根的浓度为10^-8mol/l
所以pH=5的硫酸溶液2ml稀释到1L,稀释后溶液中的c(SO42-)与c(H+)之比约为10:1追问
pH=5的硫酸溶液氢离子浓度为10^-5mol/l,是硫酸根离子浓度的两倍
体积扩大了500倍,硫酸根的浓度缩小500倍,所以此时硫酸根的浓度为10^-8mol/l
所以pH=5的硫酸溶液2ml稀释到1L,稀释后溶液中的c(SO42-)与c(H+)之比约为10:1追问
扩大500倍PH变为7是怎么算的。。。
第2个回答 2012-04-09
颤颤。一颗心紧缩着,本能地抵御着袭入的寒气,诵颂着“忽如一夜春风来,千树万树梨花开”的诗句,放飞着“晨起开门雪满山,雪晴云淡日光寒”的畅想,遥忆着“白雪却嫌春色晚,故穿庭树作飞花”的美好时光。然后,雪又剥开我紧锁的灵魂,轻轻地擦拭玷着斑斑锈迹,呈现出初春时村庄一样的颜色。每一次落雪,都是一次生命的冼礼,都让我找回了最初的感动,都让我不堪重负的灵魂变得轻松,变得无所顾忌。
相似回答